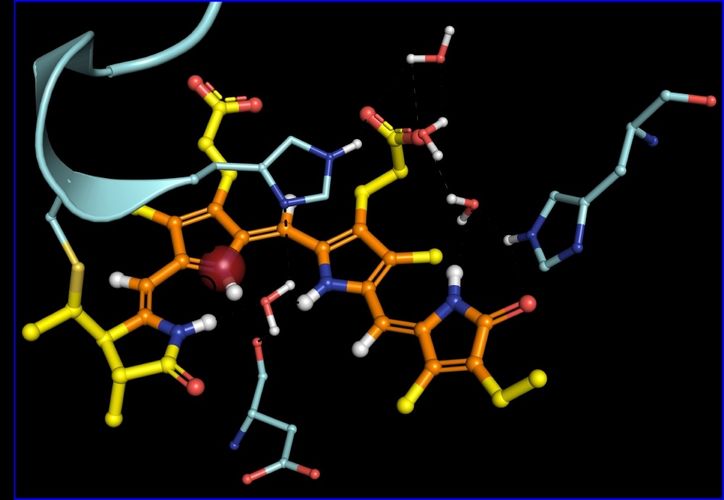
"Früher hat man diese Schaltprozesse in Phytochromen vor allem mit geometrischen Veränderungen verbunden. Heute erkennen wir, dass Verschiebungen von elektrischen Ladung ebenso stattfinden und diese genauso den Funktionsmechanismus im 'Auge' der Pflanze beeinflussen können", sagt Dr. Chen Song. Die Daten aus der Kern-Magnet-Resonanz-Untersuchung, die er mit einer neuen Methode erhalten hat, ermöglichten es ihm, diese Ladungsverteilung zu rekonstruieren. Dabei zeigte sich, dass die Ladungen in unterschiedlichen Schaltzuständen an anderen Stellen sitzen. Ist das Phytochrom im Dunkeln, sitzt die positive Ladung an einer anderen Stelle als bei Belichtung. "Wir haben noch mehr Ladungsverschiebungen unter Belichtung beobachtet. Es ist wie eine dreidimensionale Architektur, die völlig umgebaut wird", erklärt der Forscher.
Die Arbeiten zeigen, dass NMR-Spektroskopie sehr detailliert Schaltprozesse in Proteinen beobachten kann. Dr. Song will nun als nächstes untersuchen, ob in der großen Familie der Phytochrome die Schaltprozesse vergleichbar ablaufen. "Es wäre ein Paradigmenwechsel in der Protein-Biophysik", erklärt er.
Originaltitel der Veröffentlichung in "Angewandte Chemie":
"Dynamic Nuclear Polarization Provides New Insights into Chromophore Structure in Phytochrome Photoreceptors"
DOI: 10.1002/anie.201608119